|
|

|
Για επαγγελματίες υγείας
|
|
|
|
|
|
|
|
|
|
|
O έρπης ζωστήρας σχετίζεται με αυξημένο κίνδυνο καρδιαγγειακών επιπλοκών1
|
|
Τα ποσοστά εμφράγματος του μυοκαρδίου αυξάνονται παροδικά
μετά τη νόσηση από έρπητα ζωστήρα1
|
|
|
|
|
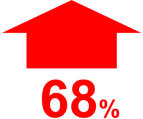
αυξημένος κίνδυνος Εμφράγματος του Μυοκαρδίου την πρώτη εβδομάδα μετά την έναρξη του εξανθήματος του έρπητα ζωστήρα1¥
|
|
|
IR(95% CI): 1.68 (1.47-1.92)
|
|
|
Το SHINGRIX έχει επιδείξει μέση αποτελεσματικότητα 87,7% έναντι έρπητα ζωστήρα σε ενήλικες ≥ 50 ετών, για τουλάχιστον 11 χρόνια μετά τον εμβολιασμό2§
|
|
|
|
|
Προστατέψτε σήμερα τους ασθενείς σας έναντι του έρπητα ζωστήρα, εμβολιάζοντάς τους με SHINGRIX!3
|
|
|
|
|
|
|
|
|
|
Σύνοψη του προφίλ ασφάλειας4
Το SHINGRIX αντενδείκνυται σε οποιονδήποτε έχει υπερευαισθησία στις δραστικές ουσίες ή σε κάποιοαπό τα έκδοχα. Όπως συμβαίνει με όλα τα ενέσιμα εμβόλια, η κατάλληλη ιατρική θεραπεία και επίβλεψηθα πρέπει να είναι πάντα άμεσα διαθέσιμη σε περίπτωση αναφυλακτικού συμβάντος μετά τη χορήγησητου εμβολίου. Σε ενήλικες ηλικίας 50 ετών και άνω οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειεςήταν άλγος στη θέση ένεσης (68,1% συνολικά/δόση, 3,8% σοβαρού βαθμού/δόση), μυαλγία (32,9% συνολικά/δόση, 2,9% σοβαρού βαθμού/δόση), κόπωση (32,2% συνολικά/δόση, 3,0% σοβαρού βαθμού/δόση) και κεφαλαλγία (26,3% συνολικά/δόση, 1,9% σοβαρού βαθμού/δόση). Οι περισσότερες από αυτές τις ανεπιθύμητες ενέργειες δεν ήταν μεγάλης διάρκειας (διάμεση διάρκεια 2 έως 3 ημέρες). Η διάρκεια των ανεπιθύμητων ενεργειών που αναφέρθηκαν ως σοβαρές ήταν 1 έως 2 ημέρες Σε ενήλικες ηλικίας ≥18 ετών που έχουν ανοσοανεπάρκεια ή βρίσκονται σε ανοσοκαταστολή λόγω νόσου ή θεραπείας (αναφέρονται ως ανοσοκατεσταλμένοι (IC)), το προφίλ ασφάλειας ήταν σε συμφωνία με εκείνο πουπαρατηρήθηκε σε ενήλικες ηλικίας 50 ετών και άνω. Υπάρχουν περιορισμένα δεδομένα σε ενήλικες ηλικίας 18-49 ετών με αυξημένο κίνδυνο ΗΖ που δεν είναι IC. Συνολικά, υπήρξε υψηλότερη συχνότητα εμφάνισης κάποιων ανεπιθύμητων ενεργειών σε νεότερες ηλικιακές ομάδες:
-
μελέτες σε IC ενήλικες ηλικίας ≥ 18 ετών (συγκεντρωτική ανάλυση): η συχνότητα εμφάνισης πόνου στοσημείο της ένεσης, κόπωσης, μυαλγίας, κεφαλαλγίας, ρίγους και πυρετού ήταν υψηλότερη σε ενήλικεςηλικίας 18-49 ετών σε σύγκριση με αυτούς ηλικίας 50 ετών και άνω.
-
μελέτες σε ενήλικες ηλικίας ≥ 50 ετών (συγκεντρωτική ανάλυση): η συχνότητα εμφάνισης μυαλγίας,κόπωσης, κεφαλαλγίας, ρίγους, πυρετού και γαστρεντερικών συμπτωμάτων ήταν υψηλότερη σε ενήλικεςηλικίας 50-69 ετών σε σύγκριση με αυτούς ηλικίας 70 ετών και άνω.
Δεν υπάρχουν δεδομένα από τη χρήση του SHINGRIX σε έγκυες γυναίκες. Ως προληπτικό μέτρο, είναι προτιμότερο να αποφεύγεται η χρήση του SHINGRIX κατά τη διάρκεια της εγκυμοσύνης. Είναι άγνωστο εάν το SHINGRIX απεκκρίνεται στο ανθρώπινο γάλα. Όπως συμβαίνει με οποιοδήποτε εμβόλιο, ο εμβολιασμός με SHINGRIX μπορεί να μην έχει ως αποτέλεσμα την προστασία όλων των εμβολιασμένων.
Για την πλήρη Περίληψη Χαρακτηριστικών του Προϊόντος SHINGRIX της GlaxoSmithKline ΜΟΝΟΠΡΟΣΩΠΗ ΑΕΒΕ πατήστε
εδώ.
Βιβλιογραφία
-
Minassian C et al. PLoS Med 2017;12:e1001919
-
Strezova A, Díez-Domingo J, Tinoco JC, et al. Adjuvanted recombinant zoster vaccine (RZV) isthe first vaccine to provide durable protection against herpes zoster (HZ) in all age ranges ≥ 50years: final analysis of efficacy and safety after 11 years (Y) of follow-up. Presented at: ECCMID2024; 27–30 April 2024; Barcelona, Spain
-
SHINGRIX, Περίληψη των Χαρακτηριστικών του Προϊόντος, Οκτώβριος 2023
IR= Incidence Ratio, CI= Confidence interval
¥Μια αυτοελεγχόμενη μελέτη σειρών περιπτώσεων, σε ενήλικες ηλικίας ≥65 ετών, διαπίστωσε ότι οέρπητας ζωστήρας σχετίζεται με 68% αύξηση του κινδύνου για έμφραγμα του μυοκαρδίου την πρώτηεβδομάδα μετά τη διάγνωση του έρπητα ζωστήρα, (προσαρμοσμένο ως προς την ηλικία IR 1,68 (95% CI:1,47, 1,92)).1 Η μελέτη περιελάμβανε 24.237 δικαιούχους Medicare στις Ηνωμένες Πολιτείες, οι οποίοιείχαν διάγνωση έρπητα ζωστήρα και έμφραγμα του μυοκαρδίου.1
§
Δευτερεύων τελικό σημείο: Αποτελεσματικότητα εμβολίου έναντι του πρώτου ή του μοναδικού επεισοδίουέρπητα ζωστήρα 1 μήνα μετά από τη δόση 2 στις μελέτες ZOE-50/70. Η παρακολούθηση τωνσυμμετεχόντων ποικίλλει, από ~4 έτη στις μελέτες ZOE-50/70 (για συμμετέχοντες που δεν είναιεγγεγραμμένοι στη ZOE- Long Term Follow Up- LTFU) έως ~11 έτη για άτομα που είναι εγγεγραμμέναστη ZOE-LTFU. H ZOE-LTFU ξεκίνησε με διάμεσο χρόνο 5,6 ετών μετά τον εμβολιασμό στις μελέτεςZOE-50/70 και έληξε σε διάμεσο χρόνο 11,4 χρόνια μετά τον αρχικό εμβολιασμό (mTVC, N=7273).Περιστατικά έρπητα ζωστήρα (n/N) στην ομάδα SHINGRIX (101/13,881) και στην ομάδα HC(818/14.035). Η ομάδα εικονικού εμβολίου στις μελέτες ZOE-50/70 χρησιμοποιήθηκε για ανάλυση από τοέτος 1 έως το έτος 4 και για τον σχηματισμό των δεδομένων HC (Historical Control) για το έτος 6 και μετάτην ανάλυση στο ZOE-LTFU. Οι εκτιμήσεις για την αποτελεσματικότητα του εμβολίου προσαρμόστηκανγια την περιοχή.
2
Λ.Τ: 165,86€
% επιχορήγησης από τους οργανισμούς κοινωνικών ασφαλίσεων:
100% για τους πληθυσμούς που περιγράφονται στο Εθνικό Πρόγραμμα Εμβολιασμών Ενηλίκων1
Φαρμακευτικό προϊόν για το οποίο απαιτείται ιατρική συνταγή.
Τα ανωτέρω ισχύουν κατά την ημερομηνία σύνταξης της επικοινωνίας/εντύπου/καταχώρησης.
Παρακαλούμε επικοινωνήστε με την εταιρία για επιβεβαίωση πλήρως ενημερωμένων δεδομένων, για οποιαδήποτε πληροφορία ή/και αναφορά Ανεπιθύμητων Ενεργειών στο τηλέφωνο 2106882100.
Tα εμπορικά σήματα ανήκουν ή έχουν παραχωρηθεί στον Όμιλο Εταιρειών GSK.
|
|
Ανεπιθύμητες ενέργειες: Παρακαλείσθε να αναφέρετε οποιεσδήποτε
ανεπιθύμητες ενέργειες παρουσιάζονται σε ασθενείς σας οι οποίοι λαμβάνουν σκευάσματα της GlaxoSmithKline ΜΟΝΟΠΡΟΣΩΠΗ ΑΕΒΕ. Κατά την αναφορά, παρακαλείσθε να παρέχετε όσο το δυνατόν περισσότερες πληροφορίες, συμπεριλαμβανομένων των πληροφοριών σχετικά με το ιατρικό ιστορικό, οποιαδήποτε συγχορήγηση άλλου φαρμάκου, καθώς και τις ημερομηνίες εμφάνισης και θεραπείας.
Υπενθυμίζεται ότι οι ανεπιθύμητες ενέργειες που συνδέονται με τη χρήση σκευασμάτων της GlaxoSmithKline ΜΟΝΟΠΡΟΣΩΠΗ ΑΕΒΕ μπορούν να αναφέρονται σύμφωνα με το εθνικό σύστημα αυθόρμητων αναφορών στον Εθνικό Οργανισμό Φαρμάκων, Τμήμα
Ανεπιθύμητων Ενεργειών, με την υποβολή της Κίτρινης Κάρτας με τους εξής τρόπους:
-
Ηλεκτρονική υποβολή της Κίτρινης Κάρτας μέσω της ιστοσελίδας του ΕΟΦ.
-
Έντυπη μορφή αποστολή μέσω ταχυδρομείου, ατελώς, στο Τμήμα Ανεπιθύμητων Ενεργειών του ΕΟΦ (Μεσογείων 284, 15562) τηλέφωνο επικοινωνίας:
213-2040380 ή 213-2040337.
-
Υποβολή μέσω ΦΑΞ στο 210-6549585.
Εναλλακτικά, παρακαλείστε να αναφέρετε οποιαδήποτε ύποπτη ανεπιθύμητη ενέργεια στην εταιρεία, στο τηλέφωνο 210-6882100.
Εάν έχετε ερωτήσεις ή χρειάζεστε πρόσθετες πληροφορίες, παρακαλούμε επικοινωνήστε με το Ιατρικό Τμήμα της GlaxoSmithKline ΜΟΝΟΠΡΟΣΩΠΗ ΑΕΒΕ, τηλ. επικοινωνίας 210-6882100.
|
|
Βοηθήστε να γίνουν τα φάρμακα πιο ασφαλή και Αναφέρετε
ΟΛΕΣ τις ανεπιθύμητες ενέργειες για
ΟΛΑ τα φάρμακα
συμπληρώνοντας
την
"ΚΙΤΡΙΝΗ ΚΑΡΤΑ"
|

|
|
|
|
Αυτή η επικοινωνία ενδέχεται να περιέχει πληροφορίες και/ή συνημμένα τα οποία είναι νομικά απόρρητα ή εμπιστευτικές πληροφορίες αποκλειστικά προς γνώση των ατόμων στα οποία απευθύνεται. Εάν δεν είστε ο προοριζόμενος παραλήπτης, παρακαλούμε αγνοήστε το περιεχόμενο του μηνύματος και λάβετε υπόψη σας ότι οποιαδήποτε διάδοση, αναπαραγωγή ή αντιγραφή αυτού του μηνύματος απαγορεύεται ρητά. Εάν έχετε λάβει αυτό το μήνυμα από λάθος, παρακαλούμε ενημερώστε αμέσως τον αποστολέα μέσω τηλεφώνου και διαγράψτε το από τον ηλεκτρονικό υπολογιστή σας. Σας ευχαριστούμε για τη συνεργασία σας.
Η GlaxoSmithKline ΜΟΝΟΠΡΟΣΩΠΗ ΑΕΒΕ είναι ανώνυμη εταιρεία με έδρα στην Ελλάδα, με Αρ. ΓΕΜΗ 000276401000 και έδρα επί της Λεωφ. Κηφισίας 266, Χαλάνδρι, 152 32, Αθήνα. Το e-mail αυτόπροορίζεται αποκλειστικά για Επαγγελματίες Υγείας που εργάζονται στην Ελλάδα.
|
|

|
©2025 Όμιλος εταιρειών GSK ή δικαιοπάροχος του Ομίλου GSK
Glaxosmithkline Μονοπρόσωπη ΑΕΒΕ,
Λ.Κηφισίας 266, 15232, Αθήνα,
Τηλ. 210 6882100
|
|
|
|
|
|
PM-GR-SGX-NLTR-250003 | ΙΣΧΥΣ 05/2025 - 05/2027
|
|
|